破局儿童风湿免疫病!长春金赛Firsekibart治疗全身型幼年特发性关节炎(sJIA)Ⅱ期临床成果荣登EULAR 2025口头报告
发布时间
2025-06-19
阅读量
4721
分享
在2025年欧洲抗风湿病联盟(EULAR)年会上,由首都医科大学附属北京儿童医院风湿科李彩凤教授牵头、联合全国15家顶尖医疗机构共同开展的Firsekibart(曾用名:金纳单抗/Genakumab)治疗活动性全身型幼年特发性关节炎(sJIA)Ⅱ期临床研究(NCT05925452)关键结果,通过口头报告形式(OP0299)正式发布。作为首个头对头比较国产IL-1β抑制剂与IL-6抑制剂在sJIA患儿中疗效与安全性的研究,这一突破性成果为sJIA疾病提供了全新的治疗选择。

研究背景
全身型幼年特发性关节炎(sJIA)是幼年特发性关节炎的一个亚型,以高热、皮疹,伴或不伴关节炎为主要特征,可累及全身多脏器,炎症标志物显著升高,需与感染性疾病和恶性病进行鉴别。因此这类疾病极易漏诊、误诊,导致延误诊断,延迟治疗。 病情严重者可并发巨噬细胞活化综合征(MAS)、肺间质病变等,不仅会导致多脏器功能障碍,甚至可能危及生命。
sJIA的传统治疗主要依赖非甾体抗炎药(NSAIDs)、糖皮质激素及改善病情抗风湿药(DMARDs)。这些药物虽然能在一定程度上控制疾病,但有效性仍然有限,副作用较大,限制了其长时间应用。且仍有部分患儿对现有治疗反应不佳。因此,开发安全且有效的新型治疗药物,是当前sJIA研究领域的迫切需求。1,2,3
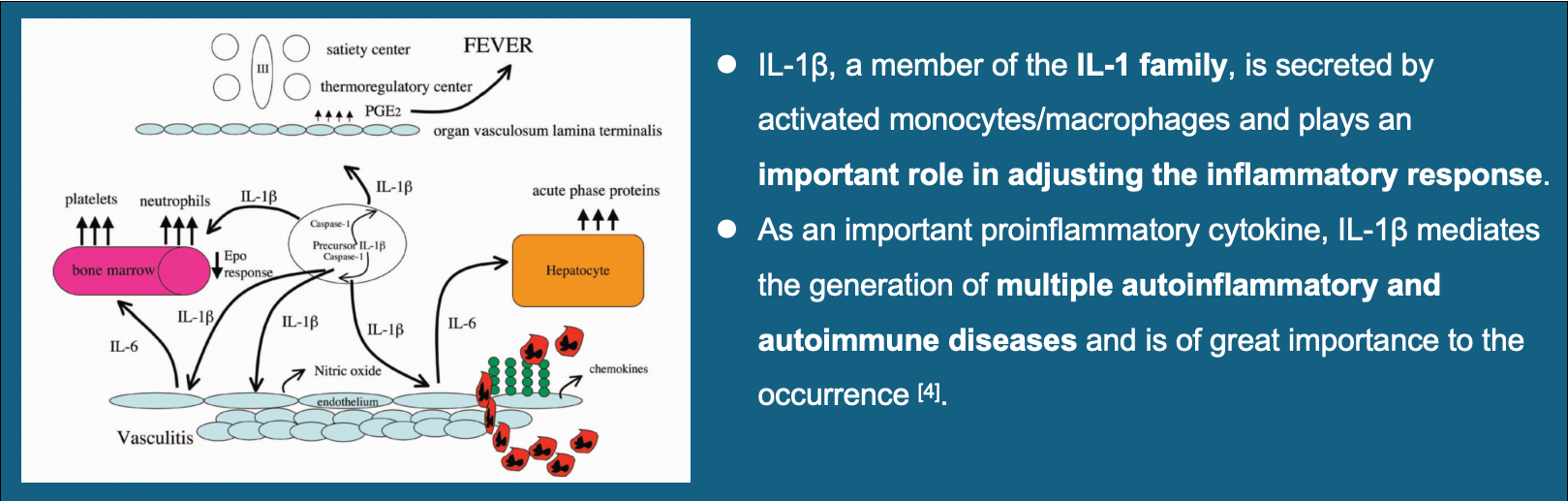
IL-1β是sJIA发病机制中的关键炎症因子,在炎症反应中发挥核心作用。Firsekibart是由金赛药业自主研发的全人源化IL-1β单克隆抗体,通过靶向抑制IL-1β的活性,从而阻断炎症反应级联放大,发挥sJIA治疗作用。本项研究旨在评估Firsekibart在治疗活动性sJIA患儿中的疗效与安全性,为临床提供新的治疗选择。4
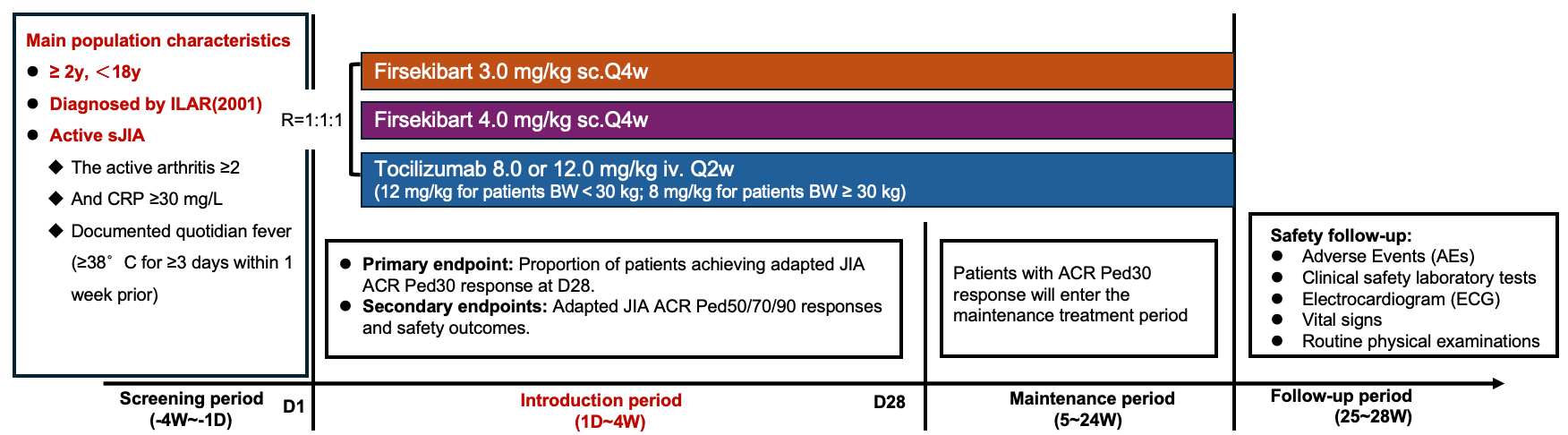
研究设计
本研究是一项多中心、随机、开放的II期临床试验, 纳入年龄在2岁至18岁之间的活动性sJIA患儿。受试者被随机分配至Firsekibart 3.0 mg/kg组、4.0 mg/kg组或Tocilizumab(托珠单抗)对照组。Tocilizumab是一种已获批用于治疗sJIA的IL-6靶点单抗,在本研究中作为阳性对照药物。
研究的主要终点为第28天达到JIA ACR Ped30反应的患者比例,次要终点则包括JIA ACR Ped50/70/90反应率以及安全性评估。
研究包括三个阶段:诱导期(4周)、维持期(20周)和随访期(4周)。本次报告为诱导期结果,在这一阶段,受试者按照随机方案接受相应治疗。诱导期结束后,达到JIA ACR Ped30反应标准者进入维持期继续治疗,同时开始糖皮质激素逐步减量;未达到应答标准者则停止治疗并进入随访阶段。
研究结果
Firsekibart在治疗sJIA方面展现出显著疗效,非劣于Tocilizumab。
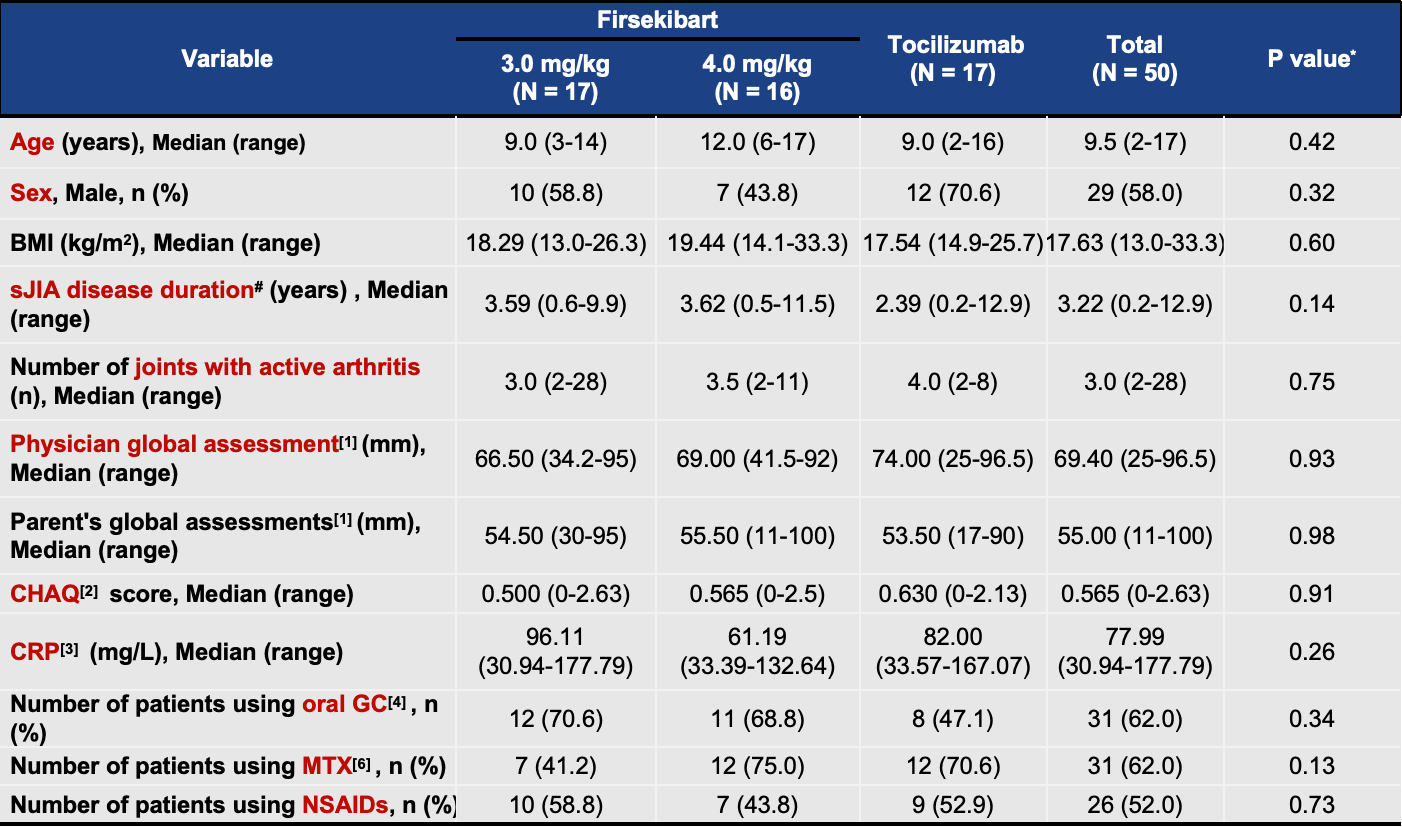
本研究共纳入50例活动性sJIA受试者,随机分配至三个治疗组:Firsekibart 3.0 mg/kg组(n=17)、Firsekibart 4.0 mg/kg组(n=16)和Tocilizumab组(n=17)。受试者平均年龄(标准差)为9.8(4.00)岁,基线体重为37.3(17.74)kg。其中男性占比为58%(29/50)。各组在基线人口统计学和疾病特征方面均衡可比。
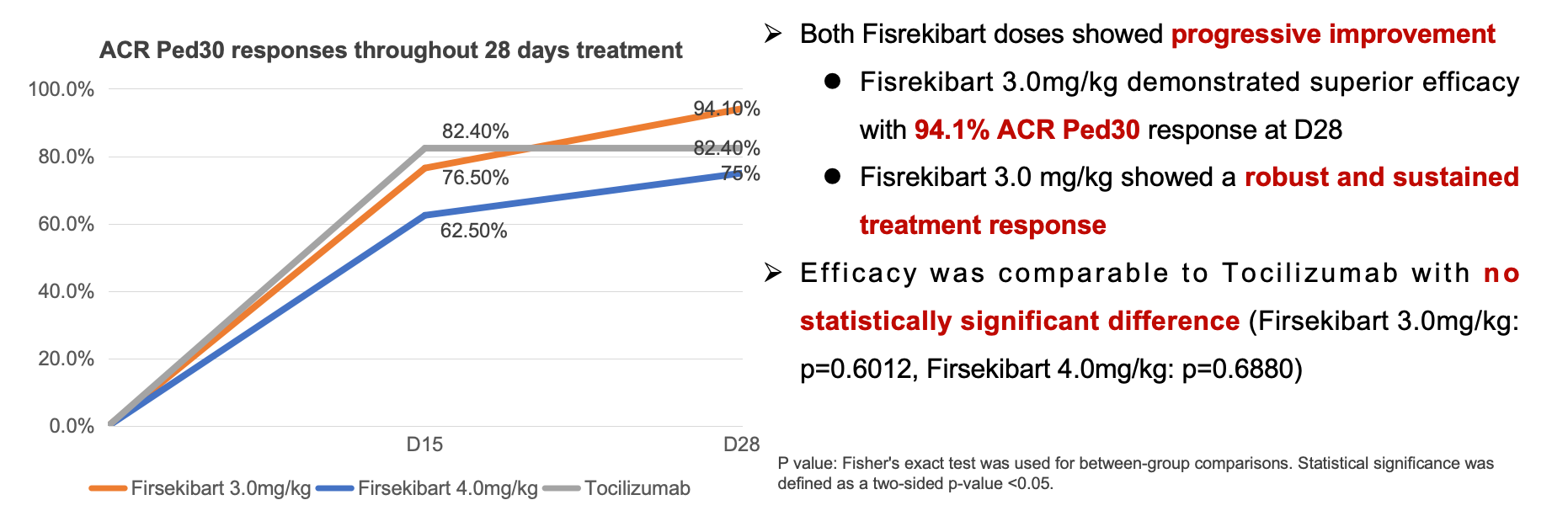
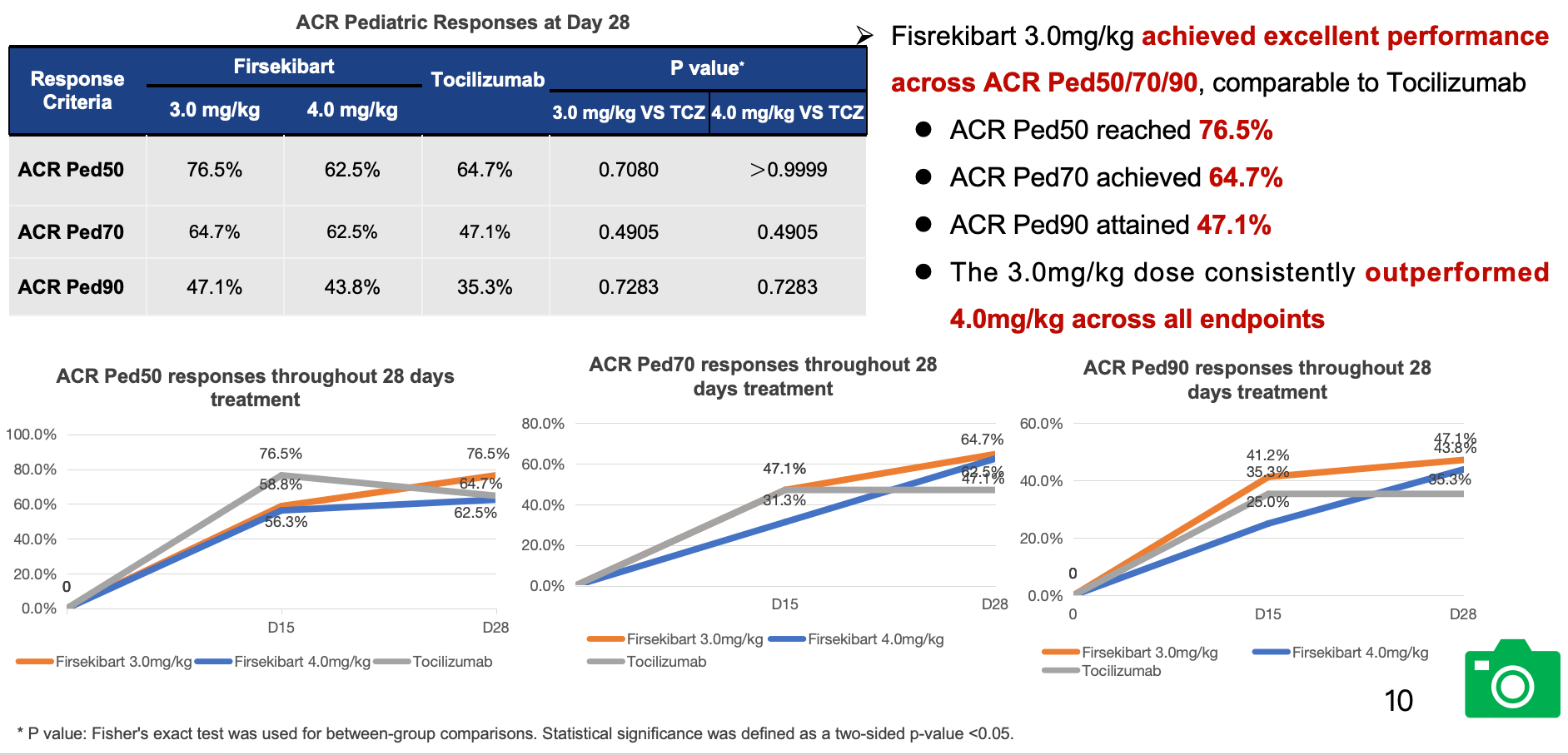
在主要疗效终点方面,Firsekibart 3.0 mg/kg组和4.0 mg/kg组达到ACR Ped30受试者比例分别为94.1%和75.0%,而Tocilizumab为82.4%。在次要终点方面,Firsekibart 3.0 mg/kg组的ACR Ped50/70/90反应率分别为76.5%、64.7%和47.1%;4.0 mg/kg组分别为62.5%、62.5%和43.8%;Tocilizumab组则为64.7%、47.1%和35.3%。上述结果表明,Firsekibart在快速控炎方面表现优异,且3.0 mg/kg剂量组的疗效非劣于Tocilizumab。
受试者基线
主要研究终点
次要研究终点
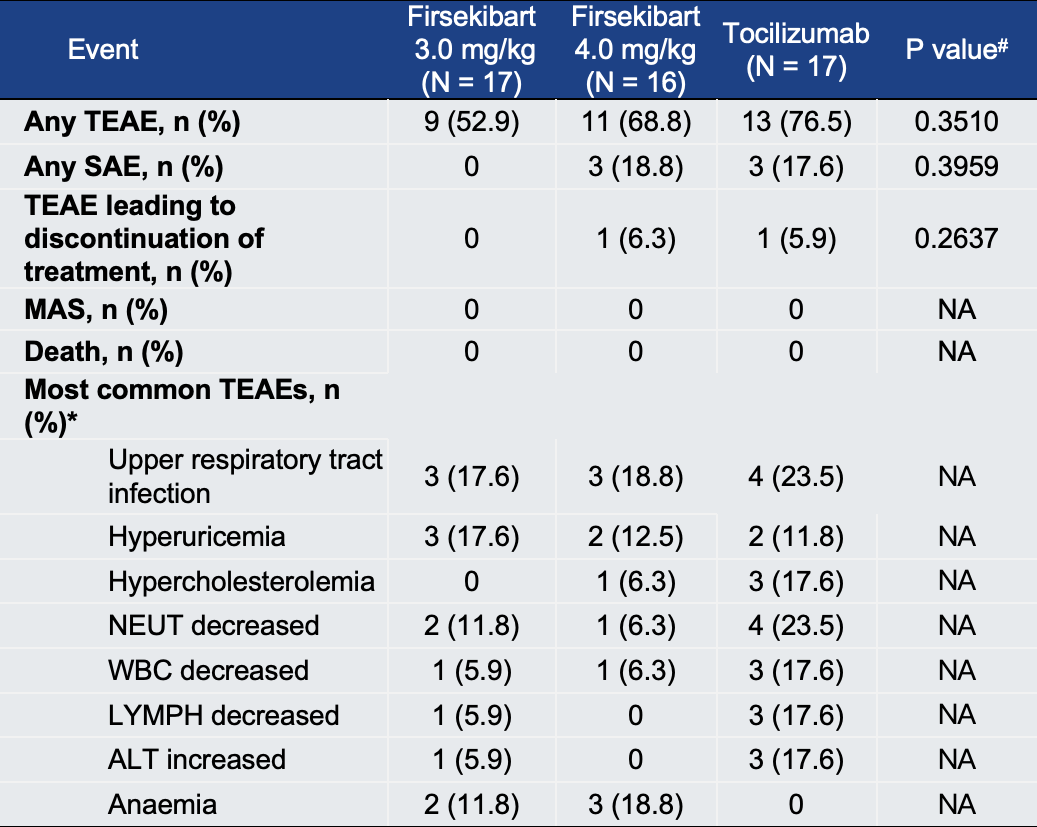
安全性良好,不良反应可控。
在安全性方面,Firsekibart显示出良好的耐受性。Firsekibart 3.0 mg/kg组的治疗相关不良事件(TRAEs)发生率为23.5%,Firsekibart 4.0 mg/kg组为50%,低于Tocilizumab组的76.5%。Firsekibart 3.0mg/kg组未报告严重不良事件(SAEs),而Tocilizumab组中有17.6%的受试者报告SAEs。Firsekibart组最常见的不良反应为上呼吸道感染、高尿酸血症和贫血,多为轻至中度,结局均为好转,与IL-1抑制剂类药物的已知安全谱相似。
李彩凤教授(首席研究者):

李彩凤,首都医科大学附属北京儿童医院 一级主任医师,教授,博士生/博士后导师
北京儿童医院郑州医院执行院长
曾任中华儿科学会全国委员、秘书长
曾任中华风湿病学会全国委员、常务委员
曾任首都医科大学风湿病学系副主任、主任
中华儿科学会风湿病学组组长
中国医师协会风湿病专科委员会常务委员、儿童风湿病学组组长
中国女医师协会风湿免疫专业委员会常务委员
北京风湿病学会副主任委员
北京医师协会风湿免疫专科医师分会副会长
北京医学教育协会风湿免疫分会副会长
海峡两岸医药卫生交流协会常务理事、儿童风湿病专委会主任委员
北京整合医学学会理事会理事、儿童风湿免疫专委会主任委员
儿科风湿病国际研究组织(PRINTO)委员及中国总协调员
亚太风湿病学会联盟(APLAR)儿科学组委员
APLAR官方SCI期刊《International Journal of Rheumatic Diseases》副主编
欧洲儿童风湿病学会PReS官方SCI期刊《Pediatric Rheumatology》编委
“sJIA患儿亟需兼顾快速控炎与长期安全性的治疗方案。Firsekibart作为一款全人源IL-1β单克隆抗体,能够精准阻断炎症核心通路。本研究首次证实,Firsekibart 3.0mg/kg剂量在28天可实现94.1% ACR Ped30的快速应答,且具有良好的安全性,有望成为sJIA治疗新选择。”
1. 中华医学会儿科学分会风湿病学组,中国医师协会风湿免疫科医师分会儿科学组,海峡两岸医药卫生交流协会风湿免疫病学专业委员会儿童学组,等.全身型幼年特发性关节炎及合并巨噬细胞活化综合征诊疗专家共识(2022版)[J].中华实用儿科临床杂志,2022,37(20):1539-1548.DOI:10.3760/cma.j.cn101070-20220422-00445.
2. 中华医学会儿科学分会风湿病学组,中国医师协会风湿免疫科医师分会儿科学组,海峡两岸医药卫生交流协会儿童风湿免疫专业委员会,等.全身型幼年特发性关节炎合并巨噬细胞活化综合征诊疗专家共识(2025版)[J].中华实用儿科临床杂志,2025,40(6):406-413.DOI:10.3760/cma.j.cn101070-20250506-00326.
3. 李彩凤,等.幼年特发性关节炎诊疗规范[J].中华内科杂志,2022,61(2): 142-156. DOI: 10.3760/cma.j.cn112138-20210929-00666
4. C. Li, et al. EFFICACY AND SAFETY OF GENAKUMAB IN ACTIVE SYSTEMIC JUVENILE IDIOPATHIC ARTHRITIS (sJIA): A MULTICENTER, RANDOMIZED, OPEN-LABEL PHASE 2 CLINICAL STUDY.DOI: annrheumdis-2025-eular.B1074









